张金华教授团队在《Nature Communication》发表重要研究成果:靶向Lypd6b为结直肠癌免疫治疗提供新策略
近日,张金华教授团队在国际著名期刊Nature Communication (Nature子刊,影响因子15.7)在线发表了题为 “Lypd6b depletion promotes CD8+ T cell-mediated anti-tumor immunity via metabolic reprogramming in colorectal cancer”的重要研究成果。首次报道了Lypd6b为新型免疫抑制分子,揭示了Lypd6b在结直肠癌免疫调控中的关键作用,系统阐明了Lypd6b缺失通过PI3K/mTOR/LDHA通路促进CD8+ T细胞糖代谢,增强其抗肿瘤免疫的分子机制,为结直肠癌免疫治疗提供了全新的分子靶点。

结直肠癌是全球高发的恶性肿瘤,其发病率和死亡率分别位居恶性肿瘤第三和第二位,严重威胁人类健康。尽管以PD-1/PD-L1抑制剂为代表的免疫检查点疗法已成为肿瘤治疗的重要手段,但仅对部分结直肠癌患者有效,多数患者存在响应不佳或耐药问题。此外,现有疗法还可能引发结肠炎、皮疹等不良反应,临床亟需挖掘新的免疫调控靶点,改善治疗效果并降低副作用。
Lypd6b(淋巴细胞抗原-纤溶酶原激活剂尿激酶受体结构域蛋白6)是一种新发现的神经调节相关分子,于2009年首次鉴定并克隆。仅被发现与神经递质受体调控、自闭症等神经领域疾病相关,其在肿瘤微环境及抗肿瘤免疫中的功能完全未知。
研究团队通过系统分析临床数据与动物模型发现,Lypd6b在结肠癌癌组织中表达水平明显高于癌旁组织,提示Lypd6b在结肠癌中可能发挥重要作用。该团队构建了Lypd6b-EGFP标签小鼠,证明了肿瘤组织中Lypd6b主要在CD8+T细胞中表达,其次在CD4+ T细胞和巨噬细胞中表达。并进一步构建了Lypd6b全身性敲除(Lypd6b−/−)和CD8+ T细胞特异性Lypd6b基因敲除(CD8Lypd6b−/−)小鼠,采用AOM/DSS诱导的原发结肠癌模型和MC38移植瘤模型,证明了Lypd6b敲除抑制结直肠癌发生和肿瘤生长。深入研究发现,Lypd6b缺失启动下游PI3K-mTOR-LDHA信号级联反应,促进CD8+ T细胞的糖酵解,抑制氧化磷酸化,进而促进CD8+ T细胞的活化和增殖,促进CD8+ T细胞的抗肿瘤免疫功能。
此外,Lypd6b敲除促进结肠癌荷瘤小鼠对奥沙利铂治疗的敏感性。Lypd6b敲除联合PD1抗体治疗,抗肿瘤效果显著增强,显示了Lypd6b在结直肠癌治疗中的临床转化潜力。
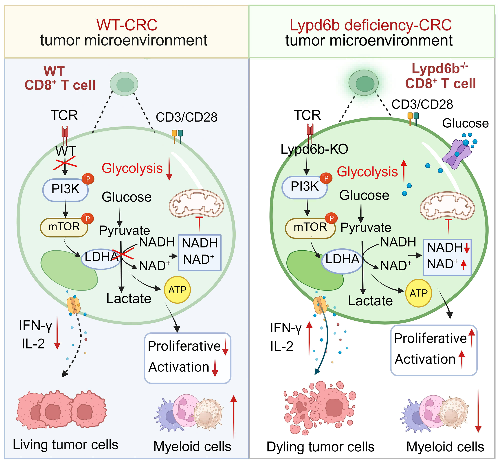
结肠癌中Lypd6b调控CD8+ T细胞代谢和抗肿瘤免疫的示意图
该研究首次将Lypd6b定义为免疫抑制分子,不仅明确了Lypd6b在结直肠癌抗肿瘤免疫中的关键作用,还揭示了Lypd6b在调节T细胞代谢重编程中的新功能,更提供了一个全新的CRC免疫治疗的潜在靶点。
本研究由北京交通大学与四川达州中心医院、北京大学人民医院、北京生命科学研究所和美国纽约大学合作完成。北京交通大学为第一作者和通讯单位。暨南大学与北京交大联合培养博士研究生刘婷为第一位置共一作者,张金华教授为主通讯作者。该研究得到了国家自然科学基金和北京自然科学基金等项目的资助。
论文链接:
//www.nature.com/articles/s41467-025-67344-w
